Ново изследване описва ранните етапи на образуване на колоректални тумори и поставя основите за подобряване на диагностиката и лечението на агресивните видове рак.
Ракът на дебелото черво, от който всяка година умират повече от 900 000 души, е характерен със своята хетерогенност. Видът на клетките и генетичните мутации, които дават началото на туморите, както и ефектът на туморната микросреда върху растежа им, могат да варират в широки граници. Това многообразие може да доведе до неправилно характеризиране на туморите, което в крайна сметка води до далеч не идеални планове за лечение.
Колоректалните тумори започват като предракови образувания, наречени аденоми, които се формират в лигавицата на дебелото черво. Тази лигавица се обновява на всеки три до четири дни, за да компенсира ежедневното износване. [1] Когато този регенеративен цикъл се наруши, се развива рак. [2] Доскоро учените смятаха, че двата вида аденоми - конвенционални и назъбени - произлизат от различни типове клетки в лигавицата на червата. Тази лигавица съдържа U-образни джобове, или крипти, с чревни стволови клетки (ISC - intestinal stem cell) в основата и диференцирани клетки в горната част.
Преобладаващата теория гласи, че конвенционалните аденоми израстват от стволови клетки в основата на криптата, докато назъбените аденоми възникват от анормални клетки в горната част. Изследователите и клиницистите наричат тези модели „отдолу-нагоре (bottom-up)" и „отгоре-надолу (top-down)" и са разработили превантивни и терапевтични стратегии въз основа на тези категории. [3]
Сега ново проучване, публикувано в Developmental Cell, опровергава тази теория, показвайки, че конвенционалните и назъбените аденоми растат само след загуба на ISC и появата на две различни популации мултипотентни стволови клетки в долната и горната част на криптата, съответно оживяващи стволови клетки и клетки на фетална метаплазия. [4]
Тези предракови клетки се делят, за да образуват аденоми, което прави двата типа тумори в тип „отдолу-нагоре“.
„Изследването разглежда важна област от биологията на колоректалния рак, използвайки строги моделни мишки. И се опитва да разгледа два пътя, по които се инициира ракът на дебелото черво“, заявява Нилай Сети (Nilay Sethi), специалист по ракова биология в Института за ракови заболявания „Дана-Фарбър“, който не е участвал в изследването.
Сети подчертава необходимостта от проучвания като това, които хвърлят светлина върху молекулярните детайли на това как се образуват и развиват трудно лечими тумори. Идентифицирането на потенциални цели за лечение може да помогне на клиницистите да се справят по-ефективно с този агресивен рак.
„Ако не разберем как се заражда един тумор, няма да можем да го предотвратим“, отбелязва Мария Диас-Меко (Maria Diaz-Meco), специалист по ракова биология в Weill Cornell Medicine и съавтор на статията.
Предишни изследвания на авторите разкриват, че загубата на две атипични изоформи на протеин киназа С (aPKC), PKCλ/ι и PKCζ, води до растеж на назъбени аденоми в червата на мишки. [5] Тези протеини регулират диференциацията и смъртта на чревните клетки.
„Открихме, че двете атипични протеин киназа С [изоформи] са намалени при колоректален рак, особено при тези пациенти, които имат по-лоша прогноза“, посочва Хорхе Москат (Jorge Moscat), специалист по онкология в Weill Cornell Medicine и съавтор на статията.
Той подчертава, че нивата на експресия на гените, кодиращи тези протеини, могат да помогнат за определяне на тежестта на заболяването при тези пациенти.
Контраинтуитивно е, че чревните клетки от мишки, при които липсва aPKC или само PKCλ/ι, не успяват да образуват жизнеспособни органоиди.
Екипът иска да разбере причината за това несъответствие и събитията, водещи до образуването на аденом. Те създават мишки, при които липсва aPKC в епителните клетки на червата, и наблюдават как това се отразява на стволовите клетки.
Делецията на aPKC в епитела не само води до образуване на назъбени тумори, но тези тумори са загубили всички ISC и вместо това имат метапластични клетки с различна идентичност. Загубата на ISC обяснява и защо тези мутантни чревни клетки не могат да се размножават, за да отгледат органоиди.
„Загубата на стволовите клетки след тази загуба на киназите беше най-изненадваща за мен. Не мисля непременно за нормалните стволови клетки, които умират, когато започва рак на дебелото черво“, коментира Сети.
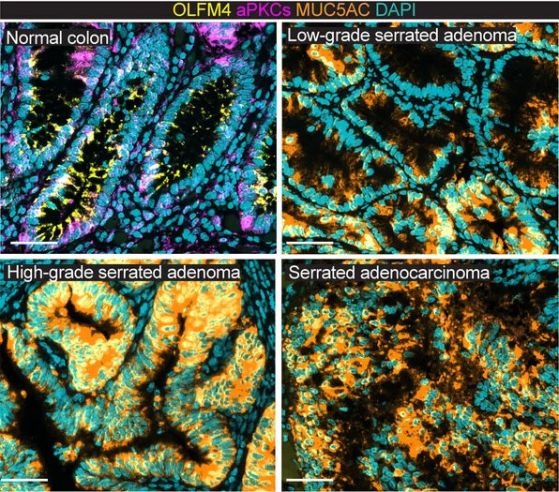
Четирипанелно изображение, показващо клетки на здрава чревна лигавица (панел 1), предраков аденом, постепенно развиващ се в раков тумор (панели 2-4). Загубата на стволови клетки, обусловена от дефицит на aPKC, предшества образуването на колоректални аденокарциноми. Изображението показва здрава чревна лигавица (ляв панел) и предраков аденом, който прогресира до образуване на раков тумор (от втория панел нататък). Кредит: Anxo Martinez-Ordoñez, Weill Cornell Medicine
За да разберат последователността на тези ранни събития, изследователите са извършили времево изтриване на едната или двете aPKC в чревни епителни клетки, включително стволови клетки, на мишки.
Делецията на PKCλ/ι и PKCζ води до силно намаляване на популацията на стволовите клетки три дни след делецията в сравнение с дивия тип мишки. Това е последвано от появата на предракови клетки в горната и долната част на криптата. Делецията само на PKCλ/ι е достатъчна, за да се възпроизведе същата верига от събития.
Екипът също така наблюдава, че делецията на aPKC води до активиране на транскрипционни програми за клетъчна смърт в стволовите клетки. Получената в резултат на това загуба на ISC води до разрушаване на цялата структура на криптата, последвано от появата на предракови клетки, които могат да се делят неконтролируемо, за да се получат аденоми, започващи от горната или долната част.
Чрез тези експерименти екипът показа, че aPKC играят решаваща роля за поддържането на ISC. Загубата на тези клетки предизвиква верижна реакция, която завършва с тумор.
Ефектите от загубата на aPKC при мишките са огледални и при хората. Екипът се сдобива с проби от конвенционални аденоми и назъбени аденоми от човешки пациенти и анализира нивата на aPKC в тях.
Всички аденоми с назъбена форма и 71% от конвенционалните аденоми имат намалени нива на aPKC в сравнение със здравата тъкан. Оцветяването на различните типове клетки в тези тумори показва, че всички назъбени аденоми и 90% от конвенционалните аденоми с дефицит на aPKC са лишени от ISC.
„Никога не сме очаквали, че стволовите клетки ще бъдат загубени. В тази област беше добре установено, че стволовите клетки са причината за рака. Така че беше много парадоксално защо тези клетки умират“, подчертава Диас-Меко.
Екипът също така изследва какво се случва в напредналите ракови тумори. Tе наблюдават силна връзка между загубата на двата белтъка aPKC и развитието на тумора.
Справка:
Rees WD, et al. Regenerative intestinal stem cells induced by acute and chronic injury: The saving grace of the epithelium? Front Cell Dev Biol. 2020;8:583919.
Cañellas-Socias A, et al. Mechanisms of metastatic colorectal cancer. Nat Rev Gastroenterol Hepatol. 2024;21:609-625.
Huels DJ, Sansom OJ. Stem vs non-stem cell origin of colorectal cancer. Br J Cancer. 2015;113(1):1-5.
Kinoshita H, et al. Epithelial aPKC deficiency leads to stem cell loss preceding metaplasia in colorectal cancer initiation. Developmental Cell. 2024;59(15):1972-1987.e8.
Nakanishi Y, et al. Simultaneous loss of both atypical protein kinase C genes in the intestinal epithelium drives serrated intestinal cancer by impairing immunosurveillance. Immunity. 2018;49(6):1132-1147.e7.
Източник: Colorectal Tumors are Born When Stem Cells Die, The scientist